Trixie Tongue Tricks – Twist, Tilt, and Train
Do you want to improve your speech, your health, and your love life with a simple and fun exercise? In this article, you will learn how to do Trixie tongue tricks, a series of tongue manipulation techniques that can enhance your tongue control, your oral hygiene, and your intimacy. You will also discover the benefits, the FAQs, and the tips for practicing Trixie tongue tricks safely and effectively.
Introduction:
Can you believe it? That quirky little wriggly pink thing in our mouths, our tongues, is itching for some action! “Trixie Tongue Tricks” isn’t just for giggles. It turns out, that giving your tongue a good ol’ stretch can potentially lead to clearer articulation and, for some, nights filled with softer snores!
Back in the Day:
Ancient yogis? They were onto something, mate. Incorporating ‘kriyas’ or tongue postures into their daily thing wasn’t just a spiritual gimmick. Nope. They reckoned it came with some real-world perks for well-being.
What’s the Buzz Now? Show off with that cherry stem trick all you want at parties. But here’s the scoop: mastering the art of tongue gymnastics is gaining a nod from more than just your impressed mates. Speech experts and even some medics are giving it a thumbs up!
The seething sea ceaseth and thus the seething sea sufficeth us.
These deliberately difficult expressions were popular in the 19th century. The popular “She sells seashells” tongue twister was originally published in 1850 as a diction exercise. The term tongue twister was first applied to this kind of expression in 1895.
“She sells seashells” was turned into a popular song in 1908, with words by British songwriter Terry Sullivan and music by Harry Gifford. According to folklore, it was said to be inspired by the life and work of Mary Anning, an early fossil collector. However, there is no evidence that Anning inspired either the tongue twister or the song.
She sells sea-shells by the sea-shore.
The shells she sells are sea-shells, I’m sure.
For if she sells sea-shells by the sea-shore
Then I’m sure she sells sea-shore shells.
Deep Dive:
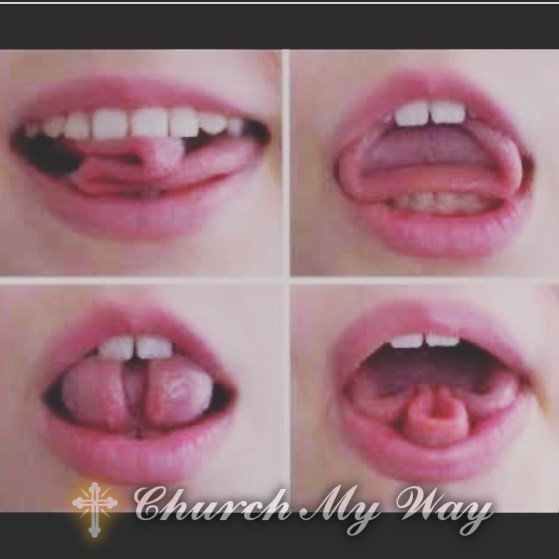
Here’s a juicy bit: your tongue? It’s not flying solo! It’s a jumbled team of various muscles. How about trying out “The Trixie Tease”? Pop your tongue out and shimmy it side-to-side. Not just a cheeky move—it’s your tongue getting its groove on!
Practical Uses:
Who’s in the loop? Singers, presenters, those drama folks! A quick tongue stretch, and bam! Their words flow like liquid gold, and those stage acts? Electric!
Another well-known tongue twister is “Peter Piper“:
Peter Piper picked a peck of pickled peppers
A peck of pickled peppers Peter Piper picked
If Peter Piper picked a peck of pickled peppers
Where’s the peck of pickled peppers Peter Piper picked
Hmm… But: Hold your horses! There’s chatter about reduced snoring, and some even say better digestion after these exercises. But the brainy lot with their lab coats? They’re going, “Hold up, folks, we’re still digging!”
FAQs:
- My speech is a bit wonky; these tongue things might help.
Could be! They might just be the secret sauce in speech therapy. But, you know, get a professional in on it, yeah? - How long till I see some magic?
Ah, it’s the waiting game! Some folks? Just a handful of weeks. Others? Might be a smidge more. Patience, my friend!
Looking Ahead: Keep those ears pricked! With all the studies zooming in, we might be on the brink of a “Trixie Tongue Tsunami”! Or…maybe not. Who knows?
Wrap-Up:
Chuckle at the “Trixie Tongue Tricks” all you fancy, but here’s the raw deal: your tongue is raring for a workout. Time to shine a spotlight, yeah? That tongue of yours? It’s low-key flexing! The ancients? They had inklings about this whole tongue magic. Clear talking, power-packed singing—it’s like tongue boot camp.
Trixie tongue tricks are a great way to spice up your life with a little tongue magic. By following the techniques and tips in this article, you can master the art of tongue manipulation and enjoy the rewards. Whether you want to improve your speech, your health, or your love life, Trixie tongue tricks can help you achieve your goals. So what are you waiting for? Start twisting, tilting, and training your tongue today!
Stuff You Should Peek At:
Tongue twister – Dive deep into the world of tongue-tastic workouts. Dive in, folks! Dive right in!